 | Démocrite, penseur grec du Vème siècle avant JC, reprenant les préceptes de son maître le philosophe Leucippe, propose une théorie "atomique" : | La matière est faite de particules indivisibles ("atomos" en grec). |
 | Au IVème siècle avant JC, Empédocle, en contradiction avec ce qu'édicte Démocrite, propose cette théorie : | l'Univers est formé de quatre éléments :
|
 | A la même époque, Aristote renforce la théorie des quatre éléments d'Empédocle en attribuant des qualités à chacun des quatre éléments fondamentaux : froid, sec, chaud et humide. Ces caractéristiques, accolées deux à deux, forment ces éléments. Ceux-ci, à leur tour, composent l'Univers entier. Cette théorie parvient à expliquer plusieurs phénomènes physiques. | 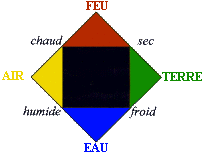 |
| 23 siècles passent... | ||
 | En 1808, John Dalton, chimiste et physicien anglais, reprend et approfondit la notion d'atome de Démocrite : |
|
 | En 1869 Dimitri Ivanovitch Mendeleïev, professeur de chimie à St-Pétersbourg classifie les éléments en se basant sur leurs propriétés. En rédigeant un volume de chimie, il se rend compte qu'en plaçant les éléments en ordre croissant de leur masse atomique, il apparaît une tendance en ce qui concerne les propriétés, tendance qui se répète à plusieurs reprises. | |
 Premier tableau de Mendeleïev | Mendeleïev disposa son tableau de manière à ce que la périodicité apparût nettement, mais pour respecter la loi périodique à laquelle il croyait fermement, il du parfois modifier l'ordre déterminé par la progression des masses atomiques et laisser certaines cases vides. Il était persuadé qu'on finirait bien par découvrir les éléments manquants, ce qui confirmera le bien-fondé de sa théorie. Il va même jusqu'à prédire les propriétés de trois éléments manquants en se basant sur les propriétés des quatre éléments voisins, et qu'il appelle provisoirement eka-aluminium, eka-bore et eka-silicium. Entre 1875 et 1886, ces trois éléments (gallium, scandium et germanium) furent découverts. Chacun possédait bien les propriétés prédites par le chimiste russe. Jusque là, très peu de scientifiques acceptaient les idées de Mendeleïev. Mais lorsque ces éléments prédits par ce dernier furent découverts, présentant de surcroît des propriétés très proches de celles qu'il avait prévues, les scientifiques reconnurent l'utilité de son tableau. | |
Comment lire le tableau
Les rangées horizontales dans le tableau périodique forment les périodes. Les électrons des éléments d'une même période sont distribués sur un même nombre de couches électroniques, nombre donné par le numéro de période.
Les colonnes verticales, quant à elles, forment les familles. Les éléments appartenant à une même famille ont en commun certaines caractéristiques.
C'est donc dire que les propriétés chimiques semblables reviennent périodiquement, d'où le nom de tableau de classification périodique.
Voici le nom des quatre principales familles chimiques :
- Les alcalins se situent à l'extrême gauche du tableau. Tous les éléments de cette famille chimique ont en commun une très grande réactivité aux non-métaux et à l'eau. En réagissant avec cette dernière, ils forment un alcali, d'où leur appellation. Ce sont des métaux mous, légers et d'aspect argenté. Ils n'existent pas à l'état pur dans la nature; ils sont toujours combinés à d'autres éléments.
- Les alcalino-terreux se situent à droite de la famille des alcalins. Ils présentent en solution des propriétés alcalines et se retrouvent dans plusieurs roches. Ce sont des solides gris métalliques. Ils ont des analogies avec les alcalins, mais ils sont plus durs et moins réactifs.
- Les gaz inertes ou gaz rares se situent dans la dernière colonne du tableau de classification périodique. Tous ces éléments ont une réactivité chimique presque nulle aux autres éléments. Ils se caractérisent par une très grande stabilité chimique grâce à leurs couches électroniques saturées. Incolores à l'état naturel, ils émettent des couleurs caractéristiques dans des tubes à vide.
- Les halogènes se situent dans la colonne à gauche des gaz inertes. Ils sont tellement réactifs qu'on ne les rencontre qu'à l'état combiné dans la nature. Cette famille tire son nom d'un mot grec qui signifie «générateurs de sels». En effet, ils forment des sels avec les alcalins; ils donnent des acides forts avec l'hydrogène.
L'hydrogène se trouve au-dessus de la famille des alcalins. En fait, il n'appartient à aucune famille chimique. Il est un élément unique en son genre pouvant se comporter comme un alcalin et parfois comme un halogène.
Les autres familles chimiques sont désignées par le nom du premier élément qui se trouve en haut de la colonne, sur le tableau périodique. On peut aussi utiliser le chiffre romain et la lettre (a ou B) qui apparaissent en haut des colonnes du tableau.




Les 8 commentaires déjà postés sur cette page :